Een steunkous voor rugweefsel
Zo’n tachtig procent van de mensen krijgt in de loop van zijn leven te maken met lage rugpijn. Dat is niet alleen vervelend voor de persoon in kwestie, maar zorgt ook voor aanzienlijke economische schade door ziekteverzuim of zelfs arbeidsongeschiktheid. Door menselijk rugweefsel in een soort steunkous te wikkelen, creëerde promovendus ir. Bart van Dijk een modelsysteem dat genezing van rugklachten dichterbij moet brengen.
Momenteel bestaan er voor chronische rugpijn eigenlijk alleen vrij drastische remedies, vertelt Bart van Dijk. “Bij beginnende klachten wordt wel fysiotherapie voorgeschreven in combinatie met pijnstillers, maar als de klachten meer dan een jaar aanhouden, kun je eigenlijk alleen nog operatief ingrijpen.” Dat gebeurt door ofwel de tussenwervelschijf te verwijderen en de aangrenzende wervels aan elkaar vast te zetten, ofwel het kraakbeen te vervangen door een implantaat van kunststof. Dat betekent overigens niet dat de klachten daarmee altijd zijn verholpen.“Beide ingrepen hebben een succespercentage van tussen de zestig en tachtig procent. Bovendien gaat het vastzetten van de schijven uiteraard ten koste van de bewegelijkheid.”
Voldoende reden om te zoeken naar betere geneeswijzen voor lage rugpijn, zou je zeggen. Therapieën waarbij cellen worden gestimuleerd om zelf nieuw, gezond weefsel aan te maken, zouden een oplossing kunnen bieden. Toch is er volgens Van Dijk betrekkelijk weinig geld beschikbaar voor onderzoek naar nieuwe therapieën. “Dat komt waarschijnlijk doordat rugpijn, in tegenstelling tot kanker en hart- en vaatziekten, geen dodelijke aandoening is. Ons onderzoeksveld is daardoor een klein wereldje met een beperkt budget.”
Een bijkomende complicatie is dat de meeste proefdieren niet echt geschikt zijn als zogeheten ‘diermodel’. Lage rugpijn ontstaat vooral door het slijten van de tussenwervelschijven, die zijn opgebouwd uit een geleiachtige kern met hieromheen een ring van vezelig kraakbeen. Net als alle kraakbeenachtige weefsels ontbreekt het de tussenwervelschijven aan de mogelijkheid om schade door slijtage te herstellen. Mogelijk spelen zogeheten ‘notochordale cellen’ een belangrijke rol in dit geheel. Deze cellen zijn overblijfselen van het notochord, de embryonale voorloper van de wervelkolom, en verdwijnen bij mensen op jonge leeftijd. De tussenwervelschijven van proefdieren zoals muizen, ratten, konijnen en varkens behouden die cellen echter wel. Het heeft daarom niet zoveel zin om (weefsel van) deze dieren te gebruiken voor onderzoek naar lage rugpijn.
Er zijn overigens wel dieren die het zonder notochordale cellen in de tussenwervelschijven moeten stellen, zoals koeien en bepaalde hondenrassen zoals teckels en beagles. “Die hondenrassen krijgen ook sneller last van hun rug dan andere honden. Het lijkt dan ook waarschijnlijk dat het ontstaan van de rugpijn verband houdt met het verdwijnen van deze cellen.” Nog afgezien van de ethische bezwaren en de hoge kosten die grotere proefdieren met zich meebrengen, heeft het ‘in vitro’ -in een bioreactor- werken met aangetast weefsel van menselijke donoren voor Van Dijk echter de voorkeur.
“Het beste diermodel is de mens”, zegt de biomedisch ingenieur. “De uitdaging is alleen om het humane weefsel in een kunstmatige omgeving in leven te houden. Je moet daarvoor de natuurlijke omstandigheden zo goed mogelijk nabootsen.” Een van de lastigste aspecten daarbij is dat het weefsel van de tussenwervelschijven veel negatief geladen eiwitten bevat. Dat zorgt voor een forse osmotische druk: door de neiging van de natuur om de concentratie opgeloste stoffen in evenwicht te houden, trekt het weefsel water uit de omgeving aan.
“Als je niets doet om dat tegen te gaan, dan zwelt het weefsel in de reactor binnen een paar uur op tot driemaal zijn oorspronkelijke omvang. Hierdoor wordt de weefselstructuur aangetast en lekken bepaalde eiwitten weg.” Een door osmotische druk opgezwollen stuk weefsel in de reactor lijkt in zoveel opzichten niet meer op natuurlijk weefsel, zodat het ongeschikt wordt voor onderzoeksdoeleinden.
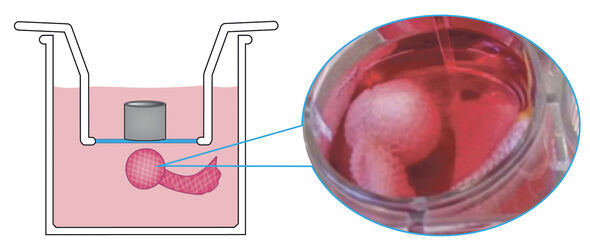
Terwijl andere onderzoeksgroepen de volledige tussenwervelschijf bestuderen, hebben Van Dijk en zijn collega’s van Orthopedische Biomechanica ervoor gekozen om alleen de geleiachtige kern van de tussenwervelschijf -afkomstig van koeien of overleden donoren met een rugaandoening- over te plaatsen naar de bioreactor. Het voordeel is dat dit systeem eenvoudiger te hanteren is. Nadeel is echter het ontbreken van de natuurlijke inbedding van het kernweefsel in een ring van kraakbeen, waardoor het weefsel in principe ongehinderd kan opzwellen. De oplossing hiervoor vormt een van de belangrijkste resultaten van Van Dijks onderzoek.
Kort gezegd stopte hij het te bestuderen weefsel, een “klompje waterige kauwgom” van ongeveer een kubieke centimeter, in een soort sok gemaakt van dyneema, een supersterke kunststof die in 1979 bij DSM is ontdekt door prof.dr. Piet Lemstra, oud-decaan van de TU/e-faculteit Scheikundige Technologie. Van Dijk: “Dat materiaal is sterker dan staal en rekt absoluut niet uit. We hebben de sok speciaal laten maken, laten breien als het ware, door een fabrikant van steunkousen. Die heeft dat deels met de hand moeten doen omdat de naalden van de naaimachine braken op de dyneema draad.”
De sok wordt in drie lagen om het weefsel gewikkeld en vervolgens dichtgenaaid, vertelt Van Dijk. “Wij zijn de eersten in de wereld die deze methode gebruiken. Het is goedkoper dan werken met volledige tussenwervelschijven en ook stabieler. Een volledige schijf blijft hooguit drie weken in leven en de koeienweefsels die we hebben gebruikt blijven minstens zes weken goed, en misschien nog wel veel langer.”
Aan het eind van zijn promotie heeft Van Dijk aangetast (versleten) weefsel uit de kern van de tussenwervelschijf van donoren tussen de zestig en tachtig jaar oud behandeld met een zogeheten groeifactor. “Dat is een enzym dat cellen stimuleert om weefsel aan te maken. Helaas moet ik zeggen dat de resultaten nog niet heel denderend zijn. Slechts in de helft van de gevallen had een injectie met groeifactoren een positief effect. En dat terwijl we al best een hoge dosis hebben gegeven, vergelijkbaar met alsof je er met een grote hamer op slaat.”
Op voorhand bestond de vrees dat de kraakbeencellen zich onder invloed van de injectie als botcellen zouden gaan gedragen en bot zouden gaan vormen. “Dat is bij levende patiënten zeker een risico. Wij hebben daar echter niets van gezien. Om het weefsel over een langere periode bloot te stellen aan de groeifactoren, hebben we ook nog gewerkt met een soort injecteerbare pil die de stof langzaam afgeeft. Bij de lage concentraties die daardoor ontstaan zagen we helemaal geen effect.”
Het is Van Dijk dus niet gelukt om zelf een veelbelovende therapie te ontdekken. Hij is echter wel positief over het modelsysteem in de steunkous. Die methode heeft nog als enig probleem dat uit aangetast menselijk weefsel nog steeds eiwitten weglekken. Die complicatie treedt niet op in het -gezonde- koeienweefsel. “Het kweken van ziek weefsel gaat dus helaas nog minder goed dan gezond weefsel, en we weten nog niet of dat komt door het weefsel zelf of de gebruikte methode. Als we dat probleem opgelost hebben, dan hebben we een perfect modelsysteem om allerlei therapieën uit te testen. Een opvolger van mij werkt ook al met deze methode aan verschillende nieuwe tests.”


Discussie